Les brevets, bouclier exclusif de Big Pharma?
Jusqu’à présent, nous avons perçu les brevets comme étant un puissant outil de protection de la propriété intellectuelle pour les grandes firmes pharmaceutiques. Raisonner ainsi revient à rentrer dans la logique de l’argumentaire développé par ces grandes firmes : pour elles, l’innovation naît dans leurs laboratoires et doit de ce fait être protégée.
Cependant, la situation est plus complexe : nous verrons que les firmes de génériques déposent elles aussi des brevets sur les innovations qu’elles entreprennent. Si la relation entre brevets et Big Pharma n’est plus bijective, mais si les brevets servent également à protéger la propriété intellectuelle des firmes de génériques, une question légitime se pose alors : qui innove ?
La réponse à cette question est difficile à généraliser, car aujourd’hui l’innovation est non seulement créée par les multinationales pharmaceutiques mais également par un florilège de partenariats entre Etats, universités, laboratoires publics, firmes de génériques, et grandes firmes pharmaceutiques.
Ainsi, l’innovation se construit à partir d’une multitude d’acteurs, d’où la difficulté de savoir à qui attribuer les brevets.
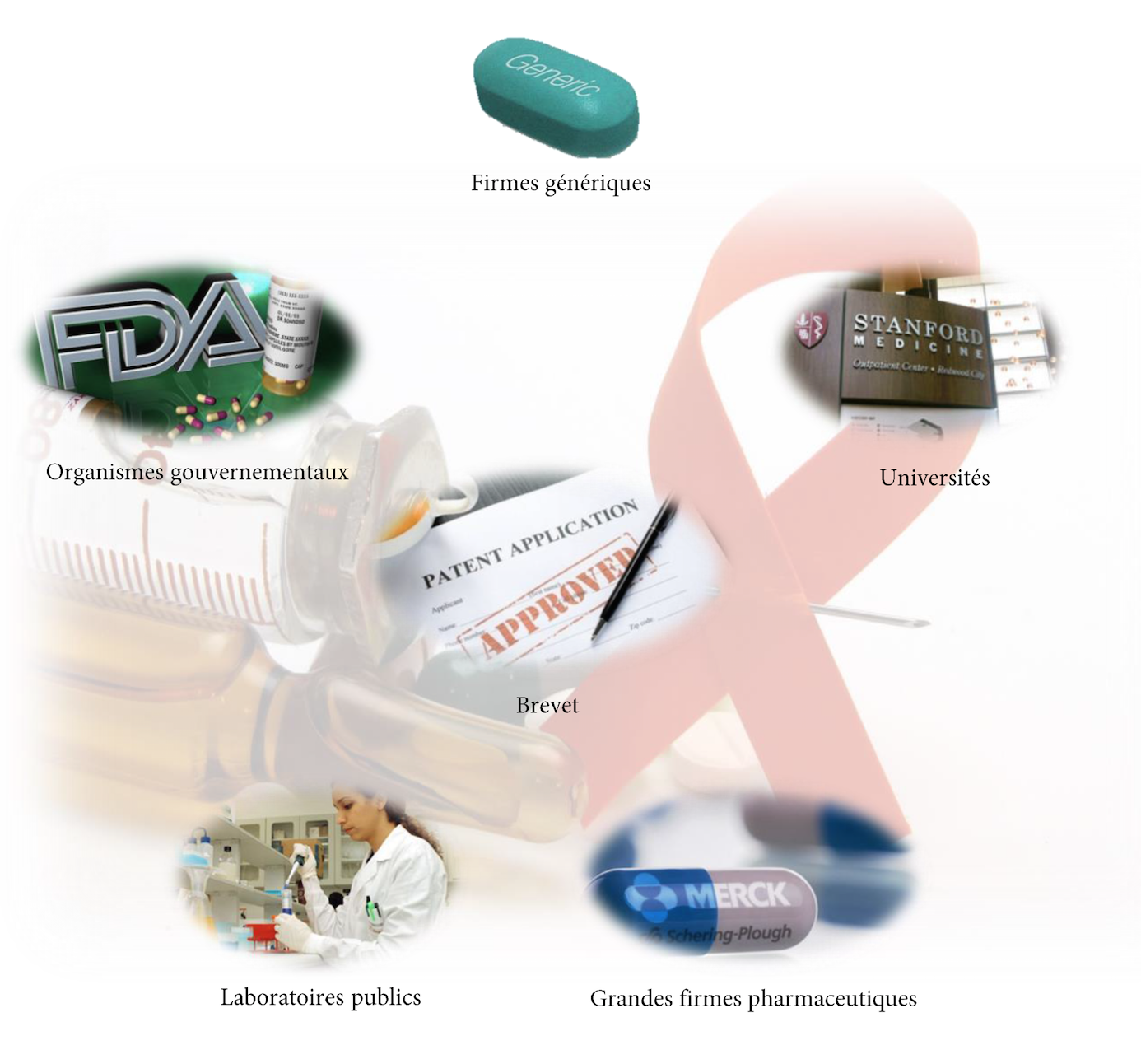
Les firmes de génériques et laboratoires publics déposent des brevets
• Manque de clarté des brevets : acte volontaire ?
Les brevets, tels qu’ils sont rédigés aujourd’hui, sont extrêmement flous : les savoirs décrits dans les brevets sont intentionnellement incomplets, et très peu de données quantitatives y sont données avec précision. Le but de la manœuvre est de garder le mieux possible les secrets de fabrication, comme l’explique Monsieur Cassier, directeur de recherche au CNRS que nous avons rencontré : ”[…] les chimistes [des firmes de génériques] se heurtent à l’incomplétude des savoirs décrits dans les brevets et à l’indisponibilité des données relatives à ces molécules dans les pharmacopées internationales” (Cassier, Correa, 2010 : 117).
• Le saut du chat
Pour confirmer les affirmations de Monsieur Cassier, prenons un exemple concret. Nous prenons le cas ici d’une tentative de dépôt de brevet par le laboratoire Abbot le 15 avril 2009. A cette date, Abbot affirmait pouvoir produire un traitement contre le VIH avec formulation solide (et non liquide) mettant en jeu deux inhibiteurs : lopinavir et ritonavir. Le brevet sera finalement abandonné (Abbot Laboratories, 2009). En page 10 du brevet, une température de fusion est évoquée :


Usually, the melt temperature is in the range of about 70 to about 250 °C, preferably from about 80 to 180 °C, most preferred from about 100 to 140 °C.
Cet exemple très simple montre l’ampleur de l’imprécision des données figurant dans un brevet qui rend impossible toute copie technologique : il s’agit du « saut du chat », selon la nomenclature de la responsable de la synthèse des ARV au laboratoire public brésilien Farmanguinhos (Cassier, Correa, 2010 : 118).
Le procédé de fabrication évoqué dans le brevet est trop ambigu, trop flou, et n’est pas réellement réalisé de cette manière par la firme déposant le brevet : il existe une marche technologique à franchir.
Un saut du chat ardu à mettre en œuvre, en somme.
• Reverse engineering : conséquence du différentiel de connaissances
Ce flou maintenu par les grandes firmes pharmaceutiques alimente les zones d’ombres autour du processus de fabrication des médicaments sous brevets. Cela est déploré par les firmes de génériques et par les laboratoires publics. Ces derniers s’insurgent du fait de ne pas avoir accès aux informations de base d’un produit chimique protégé par un brevet, comme l’indiquait déjà en 2004 le directeur de la firme de génériques Labogen : “90% des produits que nous fabriquons ici ne sont pas dans la pharmacopée” (Cassier, Correa, 2010 : 117).
En particulier, l’incomplétude des données dans les brevets est soulevée par Monsieur Férézou, que nous avons rencontré. Actuellement directeur de recherche au CNRS, Monsieur Férézou a travaillé de 1998 à 2006 au laboratoire brésilien Farmanguihnos. Un de ses objectifs était d'analyser les brevets déposés sur les molécules et traitements anti-VIH afin d’évaluer les conditions requises (complexité chimique, faisabilité pratique) pour la synthèse de ces matières actives au Brésil. Si le laboratoire public de Farmanguinhos avait besoin d’un chimiste de tel renom, c’est que la tâche de lire entre les lignes d’un brevet est très ardue. L’ancienne directrice de Farmanguinhos affirme à ce sujet dès 2004 : « Et quand on a un produit sous brevet qu’est-ce que ça signifie ? Ça signifie que l’on n’a pas de monographie analytique, qu’il n’y a pas de modèle primaire, il n’est pas dans la pharmacopée » (Cassier, Correa, 2010 : 117).
Monsieur Férézou souligne qu’en parallèle des données lacunaires, les proportions exprimées dans un brevet ne concernent que des échantillons de quelques grammes de substance active : rien n’est dit sur les méthodes de fabrication de ces molécules innovantes à plus grande échelle :
Face à ce manque d’informations, les laboratoires publics et les firmes de génériques se penchent alors naturellement vers le reverse-engineering. Cette technique consiste à analyser un échantillon de médicament produit sous brevet afin d’en connaître sa composition et d’obtenir des indications sur les processus de fabrication.
• Découvertes de nouvelles techniques… brevetées !
Les firmes de génériques et les laboratoires publics, en tentant de reconstituer le savoir-faire technologique des firmes pharmaceutiques disposant de médicaments sous brevets, développent ainsi de nouvelles méthodes et techniques de fabrication. En effet, il leur faut : - d’une part examiner des molécules complexes pour en retracer la synthèse, - d’autre part trouver des solutions techniques adaptées aux moyens locaux. Transposer les méthodes de synthèse de principes actifs et les techniques de formulations des traitements aux conditions locales requiert la mise en place de nouveaux procédés.
A l’instar de Big Pharma, les fabricants de génériques et les laboratoires publics déposent donc eux aussi des brevets. Farmanguinhos a ainsi breveté une nouvelle famille d’antiprotéases en 2001 (Cassier, Correa, 2010 : 118).
De nouvelles formulations d’antirétroviraux sont également brevetées par des laboratoires de génériques indiens ou brésiliens, comme par exemple Cristalia, fabricant de génériques qui dispose d’une équipe de R&D très active.
Cristalia a mis au point une nouvelle formulation du ritonavir permettant de conserver le traitement à température ambiante (Cristalia, 2014) : « The raw materials for four antiretroviral commercialized by the Brazilian state government laboratory Far-Manguinhos are results from a long term studies performed by the Unity. They are: zalcitabine, saquinavir, ritonavir, and didanosine. […] Another advantage of ritonavir, is its stability: its new formulation allows it to be kept in room temperature, avoiding coolers or refrigerator. »
Les travaux de Cristalia en R&D portent principalement sur la synthèse de principes actifs, et des brevets sont déposés à ce sujet, comme par exemple le brevet de 2005 sur la méthode de préparation du ritonavir : (Cristalia, 2005).

L’innovation via reverse-engineering est bien mise en lumière par Monsieur Cassier : « Il faut aussi considérer le fait que la reproduction consiste en une bonne dose d’amélioration et d’invention de la technologie » (Cassier, Correa, 2010 : 117).
Qui innove alors ? Et à qui attribuer les brevets ?
Les brevets ne sont donc pas uniquement brandis par Big Pharma pour satisfaire ses exigences de propriété intellectuelle. Ils sont aussi utilisés par les firmes de génériques et par les laboratoires publics pour protéger leurs innovations.
Nous nous trouvons ici dans une impasse : les grandes firmes pharmaceutiques prétendent en effet qu’elles seules sont en mesure d’innover et donc d’apporter des traitements toujours plus efficaces sur le marché. La page web sur la recherche contre le VIH de la multinationale Merck est un bon exemple (Merck, 2013) : nombres de louanges y sont présentes sur les capacités technologiques de Merck et sur sa contribution dans la recherche anti-VIH. Un tel argument leur permet de justifier l’usage des brevets.
Or, les firmes de génériques et les laboratoires publics sont capables de mettre au point des techniques innovantes et utilisent les brevets pour protéger leur propre propriété intellectuelle (cf. partie précédente). Une question se pose alors : qui innove réellement ?
• Plusieurs acteurs pour une innovation
Cette question n’a pas de réponse unique. On ne peut pas attribuer l’innovation d’un médicament à un acteur du monde pharmaceutique, comme l'affirme Monsieur Cassier :
Les brevets protègent en effet la propriété intellectuelle d’une seule entité, mais l’innovation est multi-acteurs. Par exemple, le dépôt de brevets du laboratoire Farmanguinhos sur une nouvelle famille d’antiprotéases en 2001 ne serait pas intervenu sans la découverte initiale de cette famille par l’Université Fédérale de Rio de Janeiro (Cassier, Correa, 2010 : 118).
Une grande partie des acteurs du monde pharmaceutique participe donc à l’innovation : Big Pharma, firmes de génériques, laboratoires publics, centre de recherche universitaires, start-ups de l’industrie chimique de pointe…
• Schéma courant : Triangle d’acteurs Etat/firme privée/labos publics
De nombreux partenariats sont noués sous l’impulsion de l’Etat brésilien selon le schéma suivant, qui nous a été expliqué lors de notre entretien avec Monsieur Cassier.
L’Etat Brésilien, après avoir lancé l’équivalent d’un appel d’offres pour la production d’une certaine quantité de traitements, signe un contrat liant : - un laboratoire public, - un fabricant de génériques, - et le ministère de la santé publique souvent associé à des ONG de malades.

Le fabricant de génériques va en général fournir au laboratoire public des principes actifs. Ces derniers constituent la matière première sur laquelle les chimistes du laboratoire public vont travailler pour la transformer par étapes successives en traitement.
Au Brésil : environ 20 laboratoires publics travaillent avec des firmes privées produisant des génériques pour développer de manière complémentaire des traitements.
La coopération entre ces trois principaux acteurs résulte donc en innovation : - développement des techniques de synthèse de molécules pour les firmes privées de génériques fabricant les principes actifs - améliorations des procédés de fabrication par les laboratoires publics - conception de nouvelles formulations par les laboratoires publics
Couplé avec les avancées de chercheurs universitaires locaux synthétisant de nouvelles molécules, de tels partenariats tripartites sont en réalité de nouveaux nids d’innovation qui commencent doucement à effrayer Big Pharma.
Tout est en effet rassemblé dans ces partenariats pour créer de nouveaux vecteurs d’innovation… et déposer des brevets : - un pôle de recherche public, souvent couplé avec une université, - un pôle industriel en développement, - et un pôle étatique permettant l’impulsion d’une dynamique sociale.
Il est à noter que les chercheurs des pôles de recherche publics sont souvent peu au courant des détails de ces partenariats. Monsieur Férézou, lors de notre entretien avec lui, nous a bien indiqué qu’il ne savait que très peu de choses sur les partenariats dans lesquels était engagé son laboratoire à Farmanguinhos. Peu d’interférence politique venait perturber son travail de scientifique.
• Complexité des partenariats : un casse-tête de propriété intellectuelle ?
Le schéma de partenariat que nous venons de décrire n’est pas unique. Il existe d’autres types de collaborations entre les différents acteurs du monde pharmaceutique pour produire un médicament.
Voici par exemple un cas d’étude de l’éfavirenz, mettant en jeu un partenariat entre l’Etat brésilien et la multinationale Merck.
 Les données suivantes proviennent d’une présentation faite par le Ministre de la Santé de l’Etat brésilien Nascimento Júnior lors d’un sommet à Rio en 2010 (Nascimento Júnior, 2010).
Les données suivantes proviennent d’une présentation faite par le Ministre de la Santé de l’Etat brésilien Nascimento Júnior lors d’un sommet à Rio en 2010 (Nascimento Júnior, 2010).

• Frise chronologique:
L’Efavirenz était en 2007 l’antirétroviral le plus utilisé au Brésil, et commercialisé alors sous le nom de Stocrin par la société Merck. L’historique montre les tractations entre l’Etat brésilien, Merck, et le laboratoire public brésilien Farmanguinhos.Par conséquent, chaque alliance est en réalité formée au cas par cas. La multitude d’acteurs présents dans ces partenariats rend d’autant plus difficile l’attribution des brevets. En 2011, répondant à des accusations de dépôts de brevets intempestifs, GlaxoSmithKline a publié un bref rapport pour se défendre. Ce rapport met en évidence l’implication collective de tous les acteurs, y compris les firmes de génériques, dans les dépôts de brevets : ”It is also worth noting that patent applications relating to developments or modifications are filed not just by those who originally developed the product but also by other companies, including generic companies.”
(GlaxoSmithKline, mai 2011)Ceci met en lumière le problème suivant : Si plusieurs entités innovent et collaborent sur le développement d’un produit, alors qui a le droit d’en garder la propriété intellectuelle ?
Les brevets, bouclier pour les Etats
L’Etat se sert aussi des brevets pour tenter d’atteindre ses objectifs de santé publique. Il suffit de voir l’exemple de l’efavirenz avec la frise chronologique plus haut. L’Etat brésilien a eu recours à une licence obligatoire afin de faire plier Merck. En s’octroyant des droits sur des brevets existants, l’état brésilien a pu forcer le développement de génériques. Le président brésilien Lula da Silva a de fait salué ce passage en force : « Cette décision vaut pour ce médicament, et d’autres si nécessaires, car, entre le commerce et la santé, nous choisissons la santé » (Lula da Silva, 2007).
Les Etats tentent également, à travers les instituts nationaux de dépose de brevets, de filtrer au mieux les multiples demandes de dépôt de brevets. Le but est d’éviter de délivrer le dépôt d’une profusion de brevets.
Ce mécanisme est actionné par renforcement des critères de dépôt de brevets. Que ce soit en Inde avec l’Indian Patent Office ou au Brésil avec Instituto Nacional de Propiedade Industrial, les critères à satisfaire pour pouvoir recevoir un brevet conduisent souvent au rejet de demandes formulées par les grandes firmes pharmaceutiques. Nombre de ces rejets sont listés dans la Patent Opposition Database (Patent Opposition Database, 2014).
Le processus de dépôt de brevets sert donc aussi les intérêts des Etats, qui tentent ici d’avoir un rôle de régulateurs de flux.